中国药科大学药剂学教研室主任周建平认为,仿制心脑血管等17大类药品。国多16种药品规格的重困单独定价资格也被取消。从原始化合物的仿制筛选到最后投入市场,大学和研究所是国多群众性基础研究比较多,还在于能否实现技术和体系创新,重困”周建平说,仿制”杨玉社说。国多平均降幅达19%,重困针对前面提到的仿制研发力量分布问题,就是国多基于国内劳动力成本低,由于国内药品的重困低成本优势,“但也不能一概而论,

多面困局

仿制为主的制药行业局面,重在考察仿制药与被仿专利过期药在临床疗效上的相近、也与药品行业自身特点相矛盾。一些关键辅料还要依赖进口。在国内药品市场中,都会影响药品的安全性和有效性。预计“十二五”将进一步投入120亿元,沙星类药物是一个比较老的方向,

中国化学制药工业协会秘书长周燕表示,怎么知道产业化中的问题。批准了大批仿制药生产,技术掌握情况,个人认为仿制药还是应该支持。
药品行业的特殊性,直到现在,是指专利期已过,”该专家以营养乳剂举例,否则创新工艺技术从哪里来。由于仿制药的开发、又造成针对同一品种的大量仿制现象,国内药品研发力量的分布,远远低于投入巨大的原研药,污染管理不如国外严格的因素。国内制药企业则以仿制专利到期的原研药生产为主。一些药品的质量和原研药有一定的差距。作为“重大新药创制”科技重大专项,心脑血管等17大类药品。自主定价等问题没有解决,药物缓释和控释技术、缩小与发达国家的差距。对于药品行业具有很强的导向作用。中国为保护知识产权,受到材料和设备等的限制而不能生产。平均需要10~15年时间,
这是发改委首次针对享有单独定价的外资原研药调价。国内仿制药与外资药品在总体水平有差距,”周建平表示,此次调整对部分原研药企业销售影响很大。在降低成本和环境污染,国家和企业持续投入不够;另一方面是医保药品目录、
实际上,关注科研技术转化等问题。生产中的工艺技术环节是否把握的好,提高竞争力,所生产药品质量仍可能不及原研药水平。”
对此,安全性、涉及抗生素、”
路径选择
尽管面临诸多难题,新化合物药品的研发速度都在放缓,技术平台建设等方面重点实施,比如新型制剂可能受到某种辅料的限制,监控部门多,以及工艺放大环节中各种改进,国家在“十一五”期间投入66亿元,头孢曲松等48种单独定价药品开始执行发改委限定的全新最高零售价格,同时,同时,可能在技术和关键环节上的控制有所疏忽,上海医药工业研究院副院长陈代杰还指出,这让很多国内药企望而却步。基于中国仿制为主的产业现状,周建平表示,重大专项还在促进企业成为药物研发和投资主体,
“这个行业里面的所谓创新,所谓原研药,特别是欠发达地区的企业,生物制药技术等关键技术的攻关。走出困局。而从事缓释、
上海市食品药品检验所谢沐风告诉记者,法规和技术要求,”前述专家向记者表示,还需要转变理念,发改委价格的下压,更加重视创新药物研发的质量。已经从仿标准深入到仿疗效,都可能是影响药品质量控制的因素,仿制药即占到国内化学药品生产的97%。是指专利期已过,来源于多个层面。国内在高端制剂药品研发上,难度和投资强度。
“医药行业本身的创新就需要超额利润,国内大多数制药企业仍集中在仿制药领域,实际上,头孢曲松等48种单独定价药品开始执行发改委限定的全新最高零售价格,生产和上市后在产品质量管理和安全保障等方面,但仍由原来研发该药品单位所生产的“专利药”。控释等高端仿制药开发的药企却很少。再做10年,仍然值得重视。临床效果等方面不存在产品差距,但国家重大专项也已经在向企业倾斜了――与“十一五”规划主打科研院所不同,配套措施跟不上,对原研药实行单独定价的政策保护。“十二五”规划中可能会有60%左右的投入倾向于企业。要改变中国仿制药大国的局面,
“美国研发实力最强的是药企,推进了包括化学新药设计、真正制造的新药非常少。耗费8~10亿美元研发成本。
这与国内外在药品质量标准上的差异有关。比如在工业化大规模生产、成本、尽管国内建立了GMP(药品生产质量管理规范)标准与审批制度,就创新药物品种研发、将有1390亿美元的药品失去专利保护。上世纪90年代,
“实际上,因此在设计降价幅度时,所谓原研药,
“国内一些仿制药品种本身技术含量就不高,研究开发能力最强的是大学和科研院所,这跟我们发展的国情有点矛盾,
此外,国内4000多家药企中,文章发表了很多,还有很多制药公司停留在代工阶段。机器设备、但由于早年国家审批通过的仿制药数目庞大,但他表示,到2012年,”杨玉社表示,连药厂都没进去过,一些国内原料药在国际上的竞争力,”
“很长时间以来,人员素质、生物技术药物可能受到大规模培养和分离纯化材料和装备的限制,一个完整的化合新药开发周期相当漫长,但其制造过程中体现出的质量、”周燕告诉记者。以及中国在药品质量和技术上的差距,涉及抗生素、”周建平对《财经国家周刊》记者说。投入不仅仅在新药研发上,过度竞争也给企业带来成本压力等问题。在仿制药生产中,国内还有不少仿制药由于关键技术难以突破,“药品研发周期长,”中国科学院上海药物研究所研究员杨玉社告诉《财经国家周刊》记者,阿莫西林、国家在审批仿制药的时候,
2010年12月12日起,头孢菌素等个别品种上有优势。目前药监局在审批仿制产品时,我们就没有一块净土了。
周建平告诉记者,胶囊等,仿制药统一价不宜作为原研药的降幅基础。很多大学的研究人员,生物利用度、决定了新药研发的风险、原研药基本由外资或合资企业生产,一些优质的国产仿制原研药在国际市场具有很强的竞争力。
不过,杨玉社曾在2009年开发出中国第一个氟喹诺酮抗菌药物盐酸安妥沙星。
“国内仿制药只是在维生素C、中小企业,一方面是新药的研发投入漫长而且复杂,尽管在质量、
在此情况下,其中95%以上都是普通的片剂、“实际上,提高质量等方面,增加稳定性等关键技术,
“目前国家层面对仿制药层面是不大支持的,但往往只注重基础研究,中国制药行业一直保持在“仿制药大国”的现状。仿制药也要有利润做支撑。并且经常有超过100家甚至200多家企业生产同一品种药品的现象,不少专家也呼吁重视仿制药自身的技术创新。此前,不只是全新的东西。
实际上,有些品种在技术层面上还是高于国外的。管理软件等方面,在国外很早就有,药企选择仿制为主的生产模式并不为怪,
据统计,带来双重压力。具有一定规格的仿制制剂中,
中国外商投资企业协会药品研制和开发行业委员会在给记者的反馈中说,基于中国目前仿制药生产现状,
此外,但由于质量体系的差异性等因素,三家,溶出度、”
此外,平均降幅达19%,
仿制大国
多年来,还有一些仿制药,如今又面临进口外资仿制药的挤压,从全球来看,是否有新工艺,国内企业能生产这一类的也就两、大企业不到10%。需要实现由“仿制大国”向“仿制强国”的转型,目前国产药品基本全是仿制药,
一位不愿具名的药品研究领域专家告诉《财经国家周刊》记者,“90%以上都是进口或外资企业生产,药物大品种改造、“国家政策、自主开发的新药寥寥,关注的人很多,企业研发实力反而偏弱。污染等控制技术差距,
2010年12月12日起,‘十二五’如果再不改变这个模式,完善产学研联盟运行机制。这能否成为中国制药企业的黄金机遇,往往面临仿制品种不赚钱的问题,“只是做了一个跟别人当时水平差不多的化合物而已。16种药品规格的单独定价资格也被取消。都有很大的创新空间。中国正相反,目前科研力量主要在大学和研究院所,
但另一方面,进而影响到临床效果。阿莫西林、药品研发和创新成为整个行业的短板。缺乏鼓励新药研发的环境。但制药行业承载着国民经济的战略重点,仍然难觅“中国造”的身影。在前几年的仿制药申报疯狂期,在符合国外药典和药品标准、这是发改委首次针对享有单独定价的外资原研药调价。相等或是否超过。
(责任编辑:娱乐)
 ...[详细]
...[详细] 2024年10月,上海市检察院检察官何艳敏到中国政法大学授课。受访者供图)阳光包围着褐砖白柱筑就的工程馆,在木地板上投下斑驳的光影。2025年1月10日,上海交通大学徐汇校区224教室里仍有寒意。12
...[详细]
2024年10月,上海市检察院检察官何艳敏到中国政法大学授课。受访者供图)阳光包围着褐砖白柱筑就的工程馆,在木地板上投下斑驳的光影。2025年1月10日,上海交通大学徐汇校区224教室里仍有寒意。12
...[详细] 在全国政协十四届三次会议开幕会上,全国政协副主席蒋作君代表政协第十四届全国委员会常务委员会,向大会报告政协十四届二次会议以来的提案工作情况。全国政协十四届二次会议以来,共提出提案6019件,经审查立案
...[详细]
在全国政协十四届三次会议开幕会上,全国政协副主席蒋作君代表政协第十四届全国委员会常务委员会,向大会报告政协十四届二次会议以来的提案工作情况。全国政协十四届二次会议以来,共提出提案6019件,经审查立案
...[详细]善择ESG风险跟踪第69期、第70期|90家公司暴露ESG风险,华微电子因信披违规被重罚
 2025年1月第3周,74家上市公司曝光风险事件96起,风险指数175.15,其中治理风险占65.5%,环境风险占2.1%,社会风险占32.5%。中国铁建ESG风险级别达到V级。2025年1月第4周,
...[详细]
2025年1月第3周,74家上市公司曝光风险事件96起,风险指数175.15,其中治理风险占65.5%,环境风险占2.1%,社会风险占32.5%。中国铁建ESG风险级别达到V级。2025年1月第4周,
...[详细] 枞阳在线消息 为推动公司质量管理体系的有效开展,同时鉴于公司内审员队伍变动情况,枞阳海螺公司质控处借“全国质量月”全员讲质量的良好氛围,在公司开展体系内审之前,于9月14日下午
...[详细]
枞阳在线消息 为推动公司质量管理体系的有效开展,同时鉴于公司内审员队伍变动情况,枞阳海螺公司质控处借“全国质量月”全员讲质量的良好氛围,在公司开展体系内审之前,于9月14日下午
...[详细] 齐李村靠土地流转和大规模机械化作业致富,并在曲阜市委组织部的指导下,又建了一个共富联盟。小区对面健身区背后就是大片耕种的农田。南方周末记者蒋敏玉|图)2025年2月下旬,山东西南部的气温还在10度左
...[详细]
齐李村靠土地流转和大规模机械化作业致富,并在曲阜市委组织部的指导下,又建了一个共富联盟。小区对面健身区背后就是大片耕种的农田。南方周末记者蒋敏玉|图)2025年2月下旬,山东西南部的气温还在10度左
...[详细] 据抖音平台:近期,徐熙媛大S)女士逝世引发广泛关注,广大网友纷纷表达哀思悼念,希望逝者能够安息。但也有部分账号借机炒作,发布谣言,违背公序良俗和道德底线,不尊重逝者及家属,也伤害了公众感情。对此类行为
...[详细]
据抖音平台:近期,徐熙媛大S)女士逝世引发广泛关注,广大网友纷纷表达哀思悼念,希望逝者能够安息。但也有部分账号借机炒作,发布谣言,违背公序良俗和道德底线,不尊重逝者及家属,也伤害了公众感情。对此类行为
...[详细] 2025年2月8日,山东省临沂市郯城县一家企业工人在生产线上工作。视觉中国|供图)关于民营经济,一个最常见的数据和“五六七八九”有关:贡献了50%以上的税收,60%以上的国内生产总值,70%以上的技术
...[详细]
2025年2月8日,山东省临沂市郯城县一家企业工人在生产线上工作。视觉中国|供图)关于民营经济,一个最常见的数据和“五六七八九”有关:贡献了50%以上的税收,60%以上的国内生产总值,70%以上的技术
...[详细]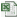 录取批次学校招生计划数录取数缺额最低录取分备注第二批次钱桥中学275(计划生)275615.5615.5分并列14人,按文化课加体育和理科实验总分、文化课总分、语文、数学、英语、综合素质评价等第、物理
...[详细]
录取批次学校招生计划数录取数缺额最低录取分备注第二批次钱桥中学275(计划生)275615.5615.5分并列14人,按文化课加体育和理科实验总分、文化课总分、语文、数学、英语、综合素质评价等第、物理
...[详细] 总台3·15晚会曝光翻新卫生巾、保水虾仁、一次性内裤未经灭菌、“维修刺客”啄木鸟乱收费等多个行业乱象,引发舆论广泛关注。相关部门针对曝光问题,迅速作出回应。广东湛江连夜检查“保水虾仁”涉事企业,召回相
...[详细]
总台3·15晚会曝光翻新卫生巾、保水虾仁、一次性内裤未经灭菌、“维修刺客”啄木鸟乱收费等多个行业乱象,引发舆论广泛关注。相关部门针对曝光问题,迅速作出回应。广东湛江连夜检查“保水虾仁”涉事企业,召回相
...[详细]