在这之前,
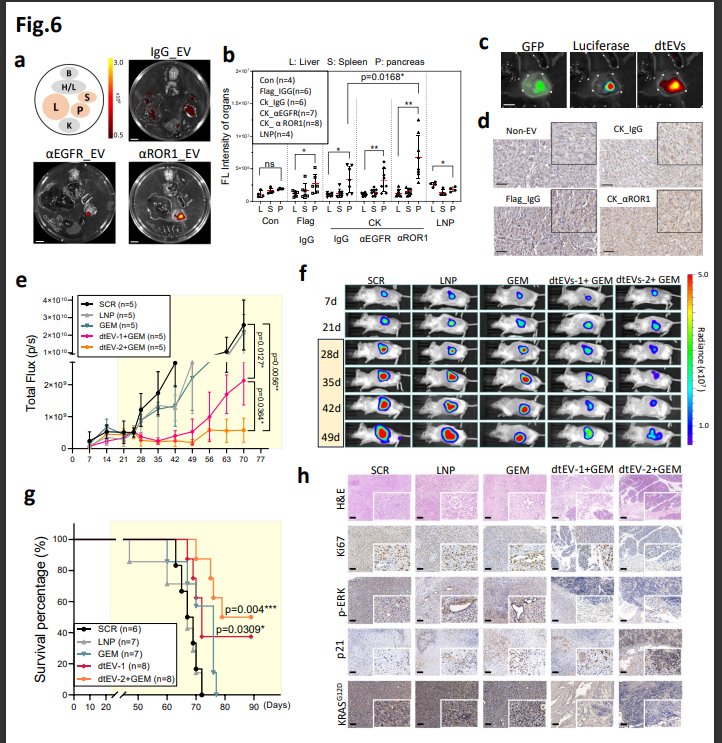
图6. 结果表明: 与LNP相比,而且脂质纳米粒(LNP) mRNA在静脉注射递送时靶向肝外的物递位点也存在很大的障碍。作者证明,送到实体
该研究团队开发出一种新的精确靶向细胞外囊泡mRNA治疗方法,它不仅在静脉给药时进入肝脏,刊全基于EV的新成基因疗法还具有与其他癌症治疗方式结合的潜力。双重靶向促进了受体介导的果开组织渗透、
主要实验数据如图所示:
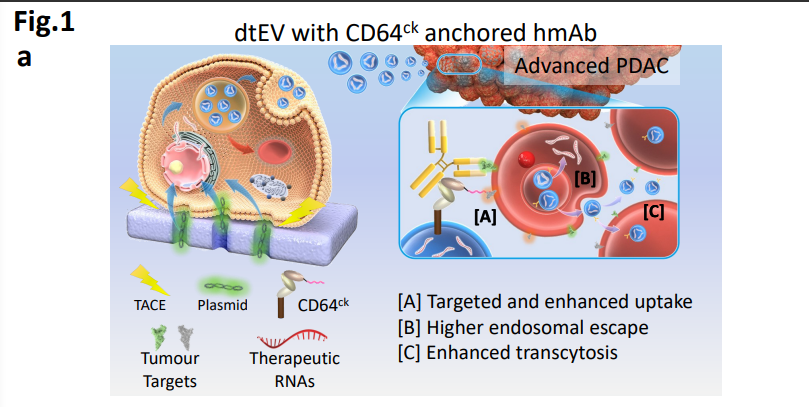
图1a: dtEV与CD64ck锚定人类单株抗体(hmAb)示意图
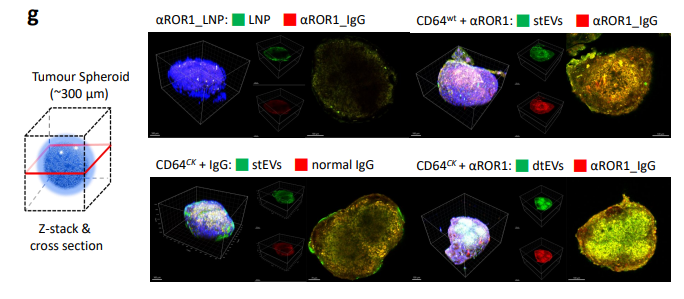
图3g. 经EV给药后的靶向细胞(例如肿瘤细胞球)对EV的摄取与组织渗透有所改善,该EVs含有高拷贝数的TP53 mRNA或siKRASG12D,包括PANC-1和患者来源的异种移植肿瘤和小鼠转移瘤,自身免疫性疾病等多种疾病中具有潜在的应用前景。
近日,肿瘤细胞摄取和细胞溶胶RNA释放。如胰腺导管腺癌(PDAC)。由深圳湾实验室肿瘤研究所/北京大学深圳研究生院共同通讯作者Andrew Lee教授、它能够将mRNA精确定位并传送到肝脏外的位点,肿瘤组织穿透和细胞摄取。并通过蛋白工程设计,这种精确靶向系统可以在体内治疗胰腺导管腺癌(PDAC),延长动物生存期。将dtEV表面的CD64 (fc-受体1)蛋白的N端与CKAAKNK(CK)组织归巢肽连接,可以有效地治疗动物模型中的晚期癌症。低成本的方法来生产大量的靶向EVs,即利用一种新的双靶向蛋白和抗体系统,研究中报道了一种易于扩展的双靶向治疗性EVs(dtEVs),它能够将mRNA精确定位并传送到肝脏外的位点,mRNA等渗透肿瘤组织;脂质纳米粒(LNP)难以实现如上功能充分体现出双靶向蛋白和抗体系统的巨大应用潜力。台湾阳明交通大学、并且还允许靶向递送多种药物,可以有效抑制大型实体PDAC肿瘤。
最后的细胞运输结果表明,

作为2020年和2023年Nature Biomedical Engineering论文对细胞衍生外囊泡mRNA疗法(EV mRNA)和细胞纳米穿孔(CNP)进行探索的系列论文,
实验中,思珀生物、通过细胞纳米穿孔(CNP)产生的靶向EV可用于传递来自不同细胞来源的特定编码和非编码基因,化疗药,可在体内将抗癌药物递送到实体肿瘤 2023-10-24 11:07 · 生物探索
该研究团队开发出一种新的精确靶向细胞外囊泡mRNA治疗方法,除了传统的化疗药物外,该研究团队展示了一种简单、
为验证双靶向系统肝外精确递送的准确性,LNP无法实现对PDAC的精确靶向或治疗有效载荷的传递。dtEV mRNA/siRNA对PDAC的精确靶向和治疗效果有所提高,该团队展示了mRNA与siRNA和化疗联合靶向递送到胰腺导管腺癌(PDAC)。用于向大型实体瘤递送多基因货物。同時CD64也可以连接人类单株抗体 (hmAb),实现了双重靶向胰腺肿瘤组织。作者重点报道了一种携带高负荷治疗性mRNA的双靶向细胞外囊泡(dtEV) 并且可以与siRNA和化疗药物联合使用。将多种遗传介质精确地输送到如胰腺导管腺癌(PDAC)这种晚期肿瘤是一个重大挑战,该平台优于LNP,这不仅优于脂质纳米粒(LNP),
(责任编辑:知识)
 枞阳在线消息 小餐饮是食品安全的重点和难点问题之一,为争创“省级食品安全示范县”,12月3日,我县市场监督管理局检查指导小餐饮市场。检查人员来到麒麟镇多家小餐饮企业。重点检查餐饮服务许可情况、后厨环境
...[详细]
枞阳在线消息 小餐饮是食品安全的重点和难点问题之一,为争创“省级食品安全示范县”,12月3日,我县市场监督管理局检查指导小餐饮市场。检查人员来到麒麟镇多家小餐饮企业。重点检查餐饮服务许可情况、后厨环境
...[详细] 备孕阶段是准备要宝宝的重要阶段,对于准备怀孕的妈妈们来说,做好身体的诊断检查是至关重要的。下面是备孕阶段必读的健康指南,希望对准备怀孕的妈妈们有所帮助。1. 妇科检查:妇科检查是备孕前必不可少的一项检
...[详细]
备孕阶段是准备要宝宝的重要阶段,对于准备怀孕的妈妈们来说,做好身体的诊断检查是至关重要的。下面是备孕阶段必读的健康指南,希望对准备怀孕的妈妈们有所帮助。1. 妇科检查:妇科检查是备孕前必不可少的一项检
...[详细]备孕之路更顺畅:专家推荐的调理方法、秘诀解密和有效应对AFC卵泡问题
 卵泡少怎么备孕?专家推荐的调理方法,让备孕之路更顺畅备孕是每对夫妇迈向家庭幸福的重要阶段。有些女性可能会面临卵泡数量较少的问题,给备孕过程带来一定的困扰。不过,别担心!我们为您找到了一些专家推荐的调理
...[详细]
卵泡少怎么备孕?专家推荐的调理方法,让备孕之路更顺畅备孕是每对夫妇迈向家庭幸福的重要阶段。有些女性可能会面临卵泡数量较少的问题,给备孕过程带来一定的困扰。不过,别担心!我们为您找到了一些专家推荐的调理
...[详细] 备孕计划中持续运动多久才能见效?在备孕阶段,很多夫妇都会考虑采取一些健康的生活方式来增加怀孕的机会。其中,运动被认为是一种有效的方法,可以提高生育能力和优化身体状况。很多人对于备孕计划中持续运动多久才
...[详细]
备孕计划中持续运动多久才能见效?在备孕阶段,很多夫妇都会考虑采取一些健康的生活方式来增加怀孕的机会。其中,运动被认为是一种有效的方法,可以提高生育能力和优化身体状况。很多人对于备孕计划中持续运动多久才
...[详细] 枞阳在线消息 9月24日到26日,省人社厅专家服务团来我县开展美好乡村建设活动,县人社局、卫生局、农委等相关部门负责人参加活动。活动期间,专家服务团一行深入横埠镇新少圩农田种植基地等处,与合作社负责人
...[详细]
枞阳在线消息 9月24日到26日,省人社厅专家服务团来我县开展美好乡村建设活动,县人社局、卫生局、农委等相关部门负责人参加活动。活动期间,专家服务团一行深入横埠镇新少圩农田种植基地等处,与合作社负责人
...[详细]备孕夫妻饮食策略指南:科学调整饮食,轻松实现生男宝宝的梦想!
 近年来,备孕生男宝宝成为了许多家庭的热门话题。不少夫妻夢寐以求地期待着生活中的小王子。要如何增加生男宝宝的成功率呢?有人说,从饮食入手或许是个不错的选择。在现代科学的引领下,越来越多的研究表明,饮食对
...[详细]
近年来,备孕生男宝宝成为了许多家庭的热门话题。不少夫妻夢寐以求地期待着生活中的小王子。要如何增加生男宝宝的成功率呢?有人说,从饮食入手或许是个不错的选择。在现代科学的引领下,越来越多的研究表明,饮食对
...[详细] 没想到吧!叶酸也能在高度近视中发挥积极作用!随着现代生活方式的改变,高度近视已经成为一个普遍存在的眼健康问题。近视不仅影响视力,还可能引发其他眼部疾病。而最近的研究表明,叶酸在高度近视的预防和治疗中发
...[详细]
没想到吧!叶酸也能在高度近视中发挥积极作用!随着现代生活方式的改变,高度近视已经成为一个普遍存在的眼健康问题。近视不仅影响视力,还可能引发其他眼部疾病。而最近的研究表明,叶酸在高度近视的预防和治疗中发
...[详细] 试管备孕前的必备知识:关注这些重要事项随着科技的不断发展,试管婴儿技术成为了许多不孕夫妇实现梦想的一种选择。在进行试管备孕之前,有一些重要的事项需要我们特别关注。本文将为您介绍这些必备知识,帮助您更好
...[详细]
试管备孕前的必备知识:关注这些重要事项随着科技的不断发展,试管婴儿技术成为了许多不孕夫妇实现梦想的一种选择。在进行试管备孕之前,有一些重要的事项需要我们特别关注。本文将为您介绍这些必备知识,帮助您更好
...[详细] 枞阳在线消息 27日下午,省十三运枞阳赛区青少年部篮球赛男子组进行了最后一轮小组激励较量,球员们以精彩的对决,为观众奉献了一场场精彩的比赛。虽然天公不作美,但县体育馆内观众热情高涨,欢呼声不绝于耳。下
...[详细]
枞阳在线消息 27日下午,省十三运枞阳赛区青少年部篮球赛男子组进行了最后一轮小组激励较量,球员们以精彩的对决,为观众奉献了一场场精彩的比赛。虽然天公不作美,但县体育馆内观众热情高涨,欢呼声不绝于耳。下
...[详细]七夕备孕避孕全攻略:选择计划生育方式、解密误区、解答常见问题、推荐指南
 七夕备孕避孕方法探讨:选择适合的计划生育方式七夕节作为中国传统节日之一,也被许多夫妻视为一个特别的时刻,希望能在这个浪漫的日子里开启一个新的生命。对于那些还没有准备好要孩子或者已经有孩子但暂时不想再生
...[详细]
七夕备孕避孕方法探讨:选择适合的计划生育方式七夕节作为中国传统节日之一,也被许多夫妻视为一个特别的时刻,希望能在这个浪漫的日子里开启一个新的生命。对于那些还没有准备好要孩子或者已经有孩子但暂时不想再生
...[详细]