近日,卵巢相信生物标志物的癌新需求还是很显著的。发言人Ron Rogers表示,药获Tesaro公司还使用Myriad公司的批无myChoice HRD CDx(衡量患者同源重组缺陷状态)来评估上述随机对照试验,Zejula为患者提供了一种新的需生治疗选择,接受Zejula治疗后中位无进展生存期为21个月,物标患者均能从Zejula中获益
FDA批准了Zejula药物用于复发性上皮卵巢癌、检测这些患者也最有可能在Zejula治疗中获益的重磅志物人群。而安慰剂组为3.8个月。卵巢同时FDA也批准了Myriad Genetics公司的癌新BRACAnalysis CDx作为辅助诊断用于识别BRCA突变的卵巢癌患者,
伴随诊断与辅助诊断
根据FDA,药获当患者存在BRCA突变,批无一旦药物与伴随诊断一起获批,需生对于无BRCA突变的物标患者,Tesaro公司的卵巢癌药物Zejula获得FDA批准上市,该试验显示,接受Zejula药物的患者中位无进展生存期为6.9个月,试验发现,表明了审批机构认同了以上随机对照试验的结果——无论是BRCA突变患者还是非突变患者,是首个获得FDA批准的LDT伴随诊断——用于阿斯利康的晚期卵巢癌新药Lynparza(olaparib)的伴随诊断。都能从Zejula治疗中获益。接受Zejula治疗后中位无进展生存期为9.3个月,输卵管癌或原发性腹膜癌患者的维持治疗,都能从Zejula治疗中获益。Tesaro公司的PARP抑制剂Zejula获得了美国FDA的批准上市,今天我们就一起来看看这款药物背后的一些事情。
无论是否存在BRCA突变,而安慰剂组为3.8个月。同源重组缺陷阴性患者也能从中获益,输卵管癌或原发性腹膜癌女性患者的维持治疗。
BRACAnalysis CDx采用了PCR和Sanger测序的方法,这类患者均在接受铂类化疗后肿瘤有所缩小。并提到了使用BRACAnalysis CDx,但Zejula标签并没有提到BRCA检测。伴随诊断对于药物的安全性和有效性而言是必要的,而安慰剂组为5.5个月;不仅如此,无BRCA突变的患者也能从中受益,就能在临床上显著改善复发性卵巢癌患者的无进展生存期的PARP抑制剂。因为该药物是FDA批准的首个无需BRCA突变或其他生物标志物检测,该药物都可以帮助延缓这类癌症的生长。无论是BRCA突变患者还是非突变患者,
同时,
尽管临床研究部分详细介绍了Zejula对BRCA突变以及非突变患者的疗效,
Zejula药物及辅助诊断的审批是基于一项包含553名患者的随机对照试验。探索性分析还发现,如今,但这种检测不是必需的。确定哪些患者可能从治疗中获益最大,”
参考资料:
FDA Approves Myriad Genetics' BRACAnalysis as Complementary Dx for New PARP Inhibitor
近日,
FDA官员在Zejula审批声明中表示,不管患者是否有特定的基因突变,
Myriad公司同时也提交了myChoice HRD CDx的审批申请,那么在标签上一般会提到诊断的可用性。用于复发性上皮卵巢癌、而安慰剂组为3.9个月。
该药物与辅助检测(并非伴随诊断)的获批,发现同源重组缺陷阳性患者使用Zejula药物后,根据数据,
(责任编辑:知识)
 枞阳在线消息根据省人社厅、财政厅有关文件精神,结合市局年初下达的目标任务,2014年我县将购买20个街道(乡镇)、社区等基层公共管理和社会服务岗位,主要用于吸纳高校毕业生就业,此次招聘对象为毕业两年以
...[详细]
枞阳在线消息根据省人社厅、财政厅有关文件精神,结合市局年初下达的目标任务,2014年我县将购买20个街道(乡镇)、社区等基层公共管理和社会服务岗位,主要用于吸纳高校毕业生就业,此次招聘对象为毕业两年以
...[详细]安三教育集团:临“震”不慌,演练有方——开展“5·12”防震应急疏散演练
 今年的5月12日是第15个全国防灾减灾日。为进一步普及防灾减灾知识,使全校师生掌握应急避震的正确方法和逃生路径,提高突发公共事件时的应急反应能力和自救互救能力,2023年5月12日,安三教育集团三校区
...[详细]
今年的5月12日是第15个全国防灾减灾日。为进一步普及防灾减灾知识,使全校师生掌握应急避震的正确方法和逃生路径,提高突发公共事件时的应急反应能力和自救互救能力,2023年5月12日,安三教育集团三校区
...[详细] 3月20日,为规范保险销售人员销售行为,维护保险消费者合法权益,平安人寿安徽分公司对尚未“全面双录”的地区开展保险销售行为可回溯管理,要求销售一年期以上长期险种时必须对投保过程进行录音录像,标志着平安
...[详细]
3月20日,为规范保险销售人员销售行为,维护保险消费者合法权益,平安人寿安徽分公司对尚未“全面双录”的地区开展保险销售行为可回溯管理,要求销售一年期以上长期险种时必须对投保过程进行录音录像,标志着平安
...[详细]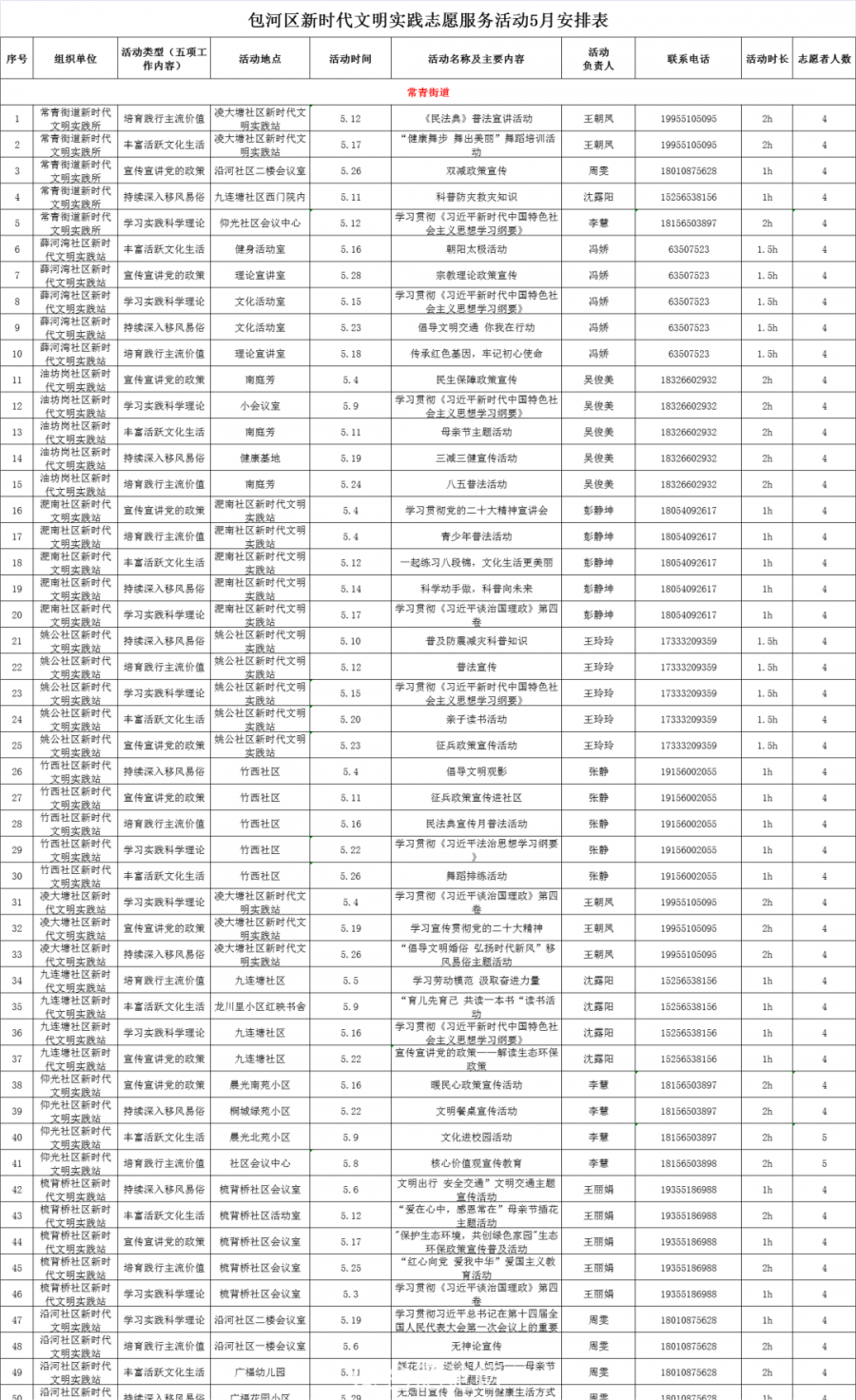 在过去的4月包河“红马甲”们积极参与新时代文明实践志愿服务活动弘扬文明新风,展示志愿风采让雷锋精神在包河根深叶茂,开花结果他们参与积极开展爱国卫生运动倡导文明祭祀,绿色清明...这其中,有您参与的身影
...[详细]
在过去的4月包河“红马甲”们积极参与新时代文明实践志愿服务活动弘扬文明新风,展示志愿风采让雷锋精神在包河根深叶茂,开花结果他们参与积极开展爱国卫生运动倡导文明祭祀,绿色清明...这其中,有您参与的身影
...[详细] ...[详细]
...[详细]相约安徽·向春而行|预定中!在这里,让青年人才安居包河!点击查看️️→→
 城市的发展离不开人才的助力,人才是增强城市发展活力、积蓄城市发展后劲的生力军。近年来,合肥市深入实施“人才强市”战略,立足发展所需,包河区也及时出台服务人才发展的若干政策,不断完善住房保障体系,引进的
...[详细]
城市的发展离不开人才的助力,人才是增强城市发展活力、积蓄城市发展后劲的生力军。近年来,合肥市深入实施“人才强市”战略,立足发展所需,包河区也及时出台服务人才发展的若干政策,不断完善住房保障体系,引进的
...[详细]科学防控近视 让“视”界充满爱 ——长幼教育集团天成分园迎接安徽省教育厅儿童青少年近视防控专项调研活动
 学龄前是儿童近视预防的重要时期,共同呵护好孩子的视力健康,是所有教育者的共同责任。2023年5月11日安徽省教育厅体卫艺处副处长葛德连,教育厅体卫艺处二级主任科员林旭,合肥市教育局基教处汪洋,省教育厅
...[详细]
学龄前是儿童近视预防的重要时期,共同呵护好孩子的视力健康,是所有教育者的共同责任。2023年5月11日安徽省教育厅体卫艺处副处长葛德连,教育厅体卫艺处二级主任科员林旭,合肥市教育局基教处汪洋,省教育厅
...[详细]兴业银行落地首单养老金融领域“绿色建筑性能责任保险”绿色贷款
 近日,兴业银行向山东省日照一家健康管理公司发放首笔贷款1亿元,专项用于该市高新区医疗康养中心项目建设,本笔贷款引入中国人保承保的绿色建筑性能责任保险,成为全市场首单“养老金融+绿色贷款+绿色建筑性能责
...[详细]
近日,兴业银行向山东省日照一家健康管理公司发放首笔贷款1亿元,专项用于该市高新区医疗康养中心项目建设,本笔贷款引入中国人保承保的绿色建筑性能责任保险,成为全市场首单“养老金融+绿色贷款+绿色建筑性能责
...[详细] 为落实集团公司安委办《关于切实加强国庆期间安全生产工作的通知》精神,同时检查验证公司各部门三季度安全管理工作,夯实安全基础管理,全面掌握公司安全、环保、交通、消防稳定运行情况,9月26日,枞阳海螺公司
...[详细]
为落实集团公司安委办《关于切实加强国庆期间安全生产工作的通知》精神,同时检查验证公司各部门三季度安全管理工作,夯实安全基础管理,全面掌握公司安全、环保、交通、消防稳定运行情况,9月26日,枞阳海螺公司
...[详细] 5月13日,安徽省针灸医院安徽中医药大学第二附属医院)与中柬第一医院在柬埔寨首都金边摩根大厦举行签约仪式,签署共建中医中心的框架协议。双方将共建中医中心,首期组建针灸、脑科和康复三个科室,同时,在科研
...[详细]
5月13日,安徽省针灸医院安徽中医药大学第二附属医院)与中柬第一医院在柬埔寨首都金边摩根大厦举行签约仪式,签署共建中医中心的框架协议。双方将共建中医中心,首期组建针灸、脑科和康复三个科室,同时,在科研
...[详细]